
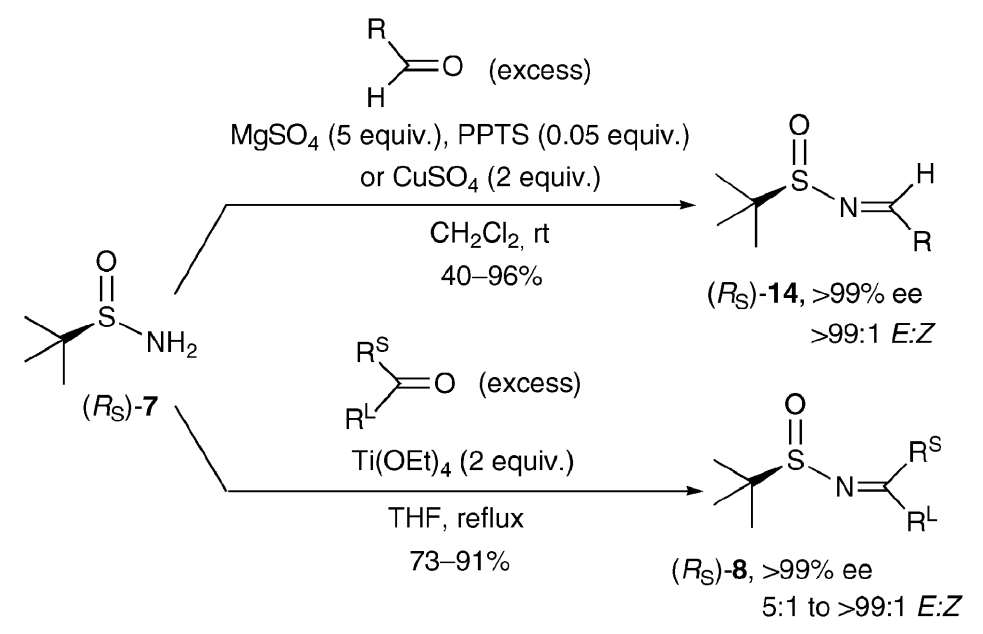
1997年,美国加州大学伯克利分校(University of California, Berkeley)的Jonathan A. Ellman教授团队开发了手性叔丁基亚磺酰胺用于制备
手性胺的方法。Jonathan A. Ellman教授团队首次设计了光学纯叔丁基亚磺酰胺的制备方法。他们发现MgSO4用作脱水剂,并加入催化量的吡啶对甲苯磺酸盐(PPTS)作为活化剂,可以将三苯甲基次磺酰胺与醛/酮高效缩合。于是,他们尝试借助这种MgSO4/PPTS组合体系来合成手性叔丁基亚磺酰亚胺取得了令人满意的结果。反应在室温下即可以良好的收率得到醛衍生的亚胺产物,其构型也没有发生明显的外消旋化。因此制备得到的手性亚胺被称为Ellman亚胺。
【Chem. Rev. 2010, 110, 3600】Ellman亚胺非常稳定,制备也很方便。叔丁基亚磺酰胺和醛缩合最有效的催化剂是Ti(OEt)4和硫酸铜。酮亚胺只能通过Ti(OEt)4制备。生成的Ellman亚胺主要是E构型。
手性叔丁基亚磺酰胺是一个优质的不对称辅助剂。手性Ellman亚胺(Ellman’s Imine)与亲核试剂反应的话可以得到高非对映选择性产物。尽管手性叔丁基磺酰胺参与反应时需要加入化学当量,属于较为原始的手性辅基控制,但经过不断的改进,这种化合物的合成技术已十分纯熟,且制备成本很低,目前已得到商品化推广,并在学术研究及工业化生产中得到了广泛的应用。
对于亲核试剂来说,有机金属试剂(有机锂试剂或Grignard试剂),氰化物(不对称Strecker反应)或,烯醇(不对称Mannich型反应)等都很适用。此反应制备手性胺可以广泛应用与α-/β-氨基酸的合成。叔丁基亚磺酰基在酸性条件下,很容易脱保护离去(HCl的MeOH溶液)。
【 Acc. Chem. Res. 2002, 35, 984】
【Angew. Chem., Int. Ed., 2001, 40, 589】
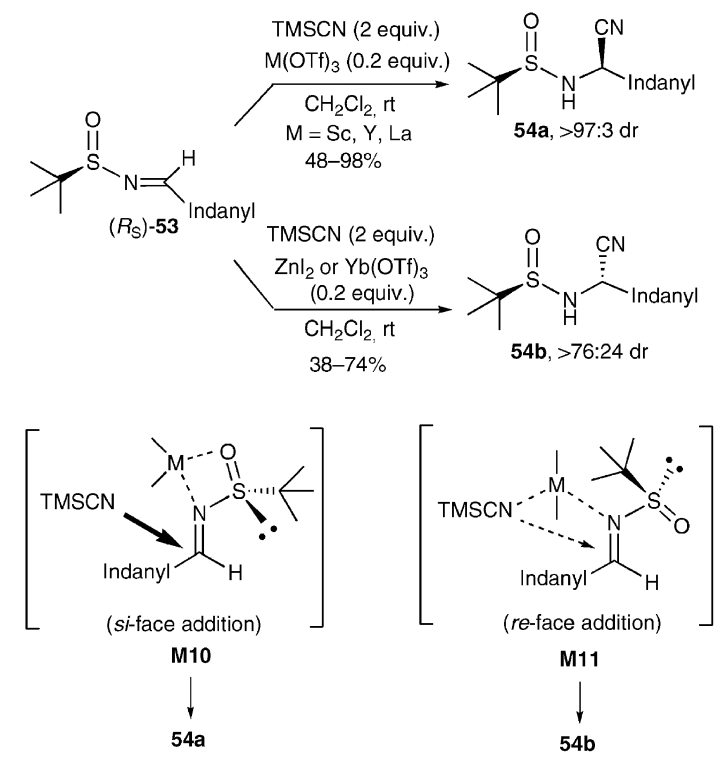
【Tetrahedron Lett., 2001, 57, 8861】
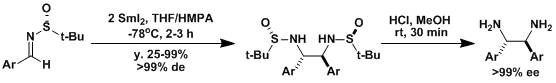
【Org. Lett. 2004, 6, 4747】【Org. Lett. 2005, 7, 1481】
【Chem. Rev. 2010, 110, 3600.】
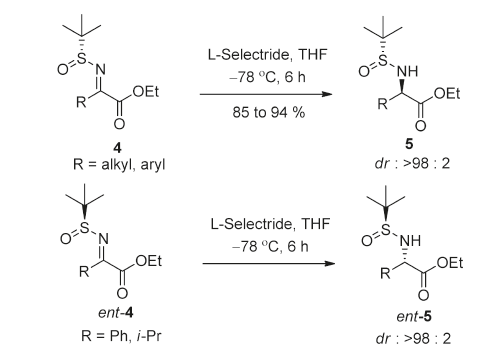

【J. Org. Chem. 2011, 76, 9, 3409–3415】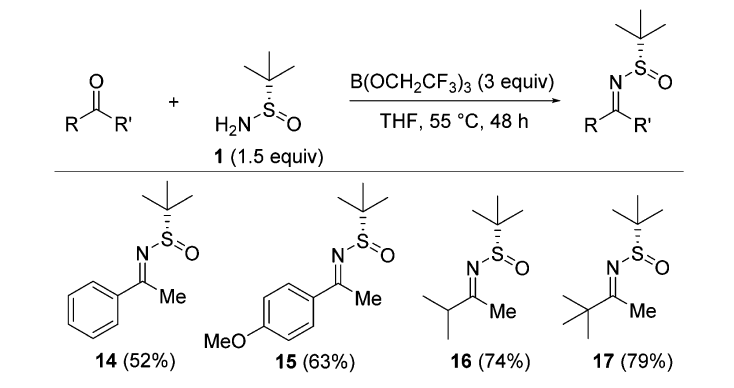
2015年,勃林格殷格翰制药公司的Jonathan Reeves等人发现了一种新的制备亚胺的试剂B(OCH2CF3)3。它可以在温和条件下制备各种Ellman亚胺。反应操作简单,无需特殊后处理,易于分离。
【Org. Lett. 2015, 17, 2442–2445】
Liu, G.; Cogan, D. A.; Ellman. J. A. J. Am. Chem. Soc. 1997, 119, 9913.
Ellman, J. A.; Owens, T. D.; Tang. T. P. Acc. Chem. Res. 2002, 35, 984.
Ellman, J. A. Pure. Appl. Chem. 2003, 75, 39.
Robak, M. T.; Hergabe, M. A.; Ellman, J. A. Chem. Rev. 2010, 110, 3600.
Xu, H.-C.; Chowdhury, S.; Ellman, J. A. Nat. Protoc. 2013, 8, 2271.
2023-6-26日摘自 有机合成 公众号